ERBB家族成员的异常信号在多种恶性肿瘤的发生发展中起重要作用。针对这些信号通路的分子靶向药物显示出强大的临床疗效,但患者不可避免地会对这些分子靶向治疗产生耐药性。尽管免疫疗法包括免疫检查点抑制剂(ICIs)在多种癌症类型的患者治疗中显示出持久的抗肿瘤反应,但在含有一些基因改变的癌症中,如ERBB家族成员激活的癌症中临床疗效有限,表明ERBB家族在抗肿瘤免疫逃逸中也有重要作用。试验显示对表皮生长因子受体(EGFR)变异的非小细胞肺癌患者和HER2变异的乳腺癌患者进行ICI治疗未能显示出临床益处,这表明EGFR和HER2信号可能在抑制抗肿瘤免疫反应中起着重要作用。
近日日本科学家在Nature Reviews Cancer发表了关于ERBB受体家族信号调控抗肿瘤免疫的综述文章,讨论了ERBB家族成员的信号传递不仅影响自主性癌症发生发展的机制(如不受控制的细胞增殖),同时也研究了肿瘤微环境中的抗肿瘤免疫反应,以及免疫基因组精准医学在免疫治疗和以ERBB家族成员信号为核心的分子靶向治疗中的潜在应用。

ERBB家族包括ERBB1-4四个受体,即EGFR、HER2、HER3和HER4。如图1,这四个受体可以形成同源或异源二聚体,不同受体有不同的配体,下游信号通路相互联系和相互重叠。其中PI3K–AKT和MAPK通路是比较重要的信号通路,另外还有PLCγ-PKC和 JAK2–STAT3信号通路。
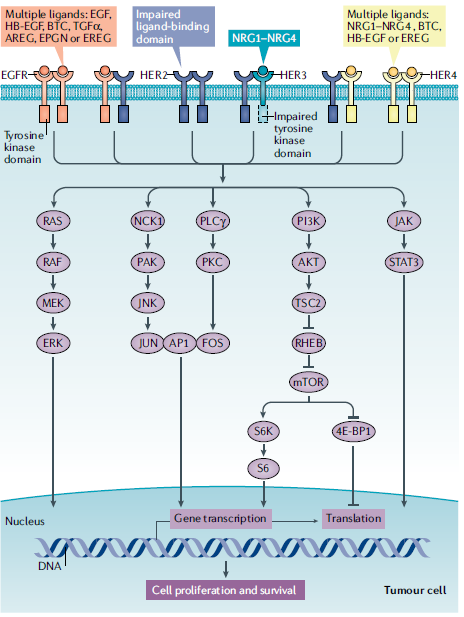
图1. ERBB信号通路
从免疫学的角度看,EGFR和HER2信号通路可以抑制IFNγ的响应,进而抑制IRF和炎症性趋化因子的产生。EGFR信号激活一般会形成非炎症免疫微环境,EGFR信号通过PI3K–Akt信号与干扰素调节因子IRF1共同下调趋化因子配体CXCL10,导致效应CD8+T细胞减少。调节性T细胞(Treg细胞)通过JNK-JUN上调CC趋化因子配体22(CCL22)的表达,在EGFR突变癌症的非炎症TME中被招募。RAS–ERK、JAK2- STAT3和PI3K–AKT–NF-κB通路产生促肿瘤细胞因子cytokines和EGFR配体。此外,骨髓细胞中的EGFR信号可诱导促肿瘤炎症,并导致EGFR配体(如HB-EGF)的表达增加。Treg细胞中的EGFR信号阻止GSK3β降解FOXP3,增强Treg细胞的免疫抑制功能。
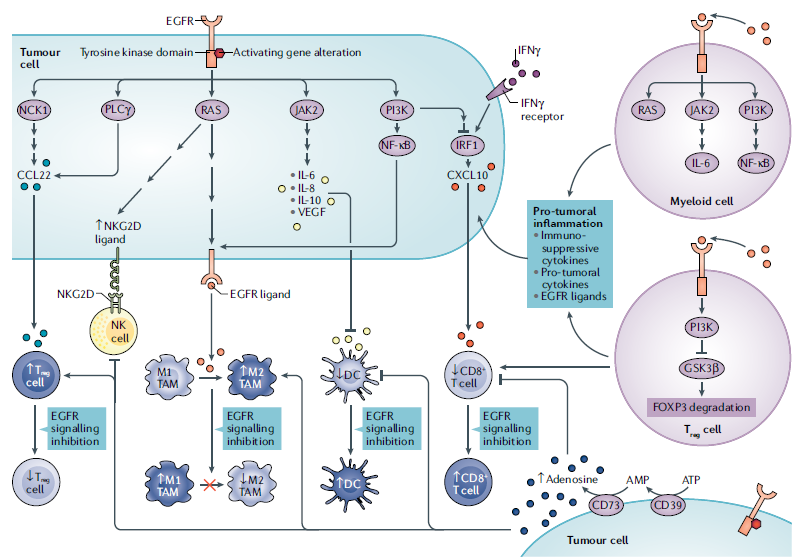
图2. EGFR信号通路在肿瘤微环境中对免疫细胞的作用
IFNγ的下调即IRF的下调可以直接抑制MHC-I的表达,与此同时PD-L1表达则被上调。MHC的下调进一步减弱了癌症的抗原性,减弱了免疫响应。如图3所示,在EGFR突变的癌症中,PI3K–AKT途径通过IRF1(MHC的转录因子之一)下调干扰素信号,RAS–RAF–MEK–ERK途径也负性调节MHC的表达。EGFR突变癌症的PD-L1表达通过两种相反的机制受到EGFR信号的影响。在癌细胞中,PD-L1表达通过激活PIK3–AKT、RAS–RAF–MEK–ERK和JAK2- STAT3途径上调。另一方面,PD-L1的表达也通过IRF1信号被γ干扰素(IFNγ)上调。在HER2扩增的癌症中,HER2诱导TBK1的去磷酸化并减弱干扰素基因(STING)信号的刺激因子,导致干扰素信号的损伤,特别是作为MHC的转录因子之一的IRF3的信号损伤。抑制EGFR或HER2异二聚体信号的分子靶向疗法增加MHCⅠ类的表达和MHCⅡ类在EGFR突变和HER2扩增癌症中的表达。
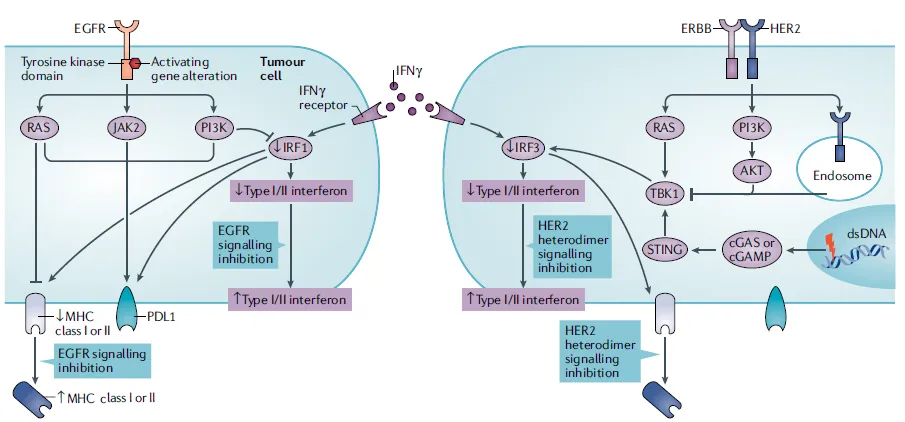
图3. EGFR变异和HER2扩增引起的癌症抗原性降低
ERBB家族信号,尤其是EGFR和HER2信号,在促进肿瘤细胞增殖以及通过上述多种机制诱导免疫抑制性TME方面起着关键作用。由于EGFR突变造成了非炎症性的肿瘤微环境(TME),因此对PD-1/PD-L1等免疫检验点疗法容易产生抵抗。既往的研究已经发现,PD-1抑制剂治疗对EGFR野生型往往比EGFR突变型更有效。同时发现,PD-1等免疫检验点抑制剂对不同的EGFR突变的效果不同,因此对联合治疗的探索,特别是对细分突变型的分子机制的探索很有必要。目前有多种联合疗法在临床试验阶段,包括ERBB通路靶向疗法与免疫检验点、VEGF抗体、CD73抗体等(表1)。图4结合免疫治疗和分子靶向治疗的概念,对ERBB家族信号传导的分子机制进行了阐述。
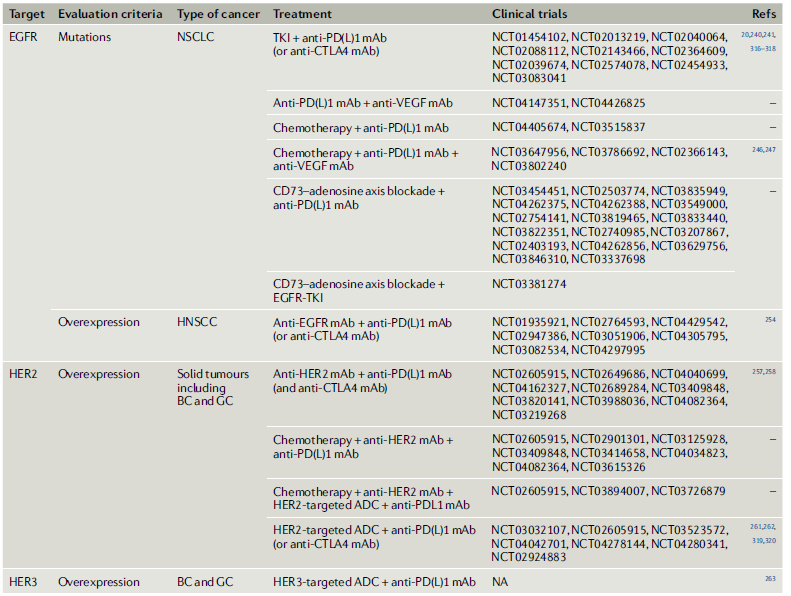
表1. ERBB家族信号变异癌症的免疫疗法联合治疗
图4a.用EGFR-TKIs(或单克隆抗体)抑制EGFR信号可阻止免疫抑制细胞的浸润并可能增强抗肿瘤反应。EGFR-TKIs促进癌细胞产生干扰素的和被效应T细胞招募的趋化因子如CXCL10,减少免疫抑制性的细胞因子和趋化因子,从而提高PD-1/PD-L1抑制剂的疗效。图4b. VEGF抑制剂是与ICIs联合治疗的选择之一。ICIs与抗VEGF单抗联合应用的疗效提高可能归因于免疫抑制细胞,特别是调节性T细胞(Treg细胞)的减少。这种联合治疗策略可能有益于对TKI耐药的EGFR突变肿瘤的治疗。图4c.
CD73单抗或A2AR拮抗剂可以抑制Treg细胞和骨髓源性抑制细胞(MDSCs)功能,增强树突状细胞(DC)和效应T细胞的活性。图4d. anti-HER2 mAbs诱导抗体依赖性细胞毒性(ADCC),导致T细胞PD-1上调和肿瘤细胞PD-L1表达上调。抗体-药物结合物(ADC)保留anti-HER2 mAbs的功能,诱导免疫原性细胞死亡及MHCI在癌细胞中的表达,导致DC成熟,与肿瘤相关巨噬细胞(TAMs)分化进入促炎M1型巨噬细胞并增加T细胞浸润。
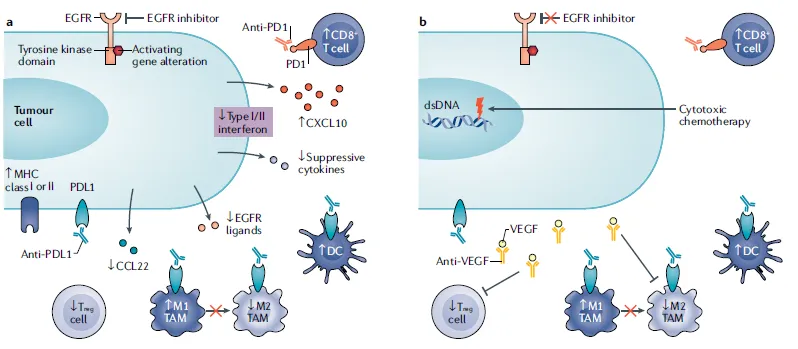
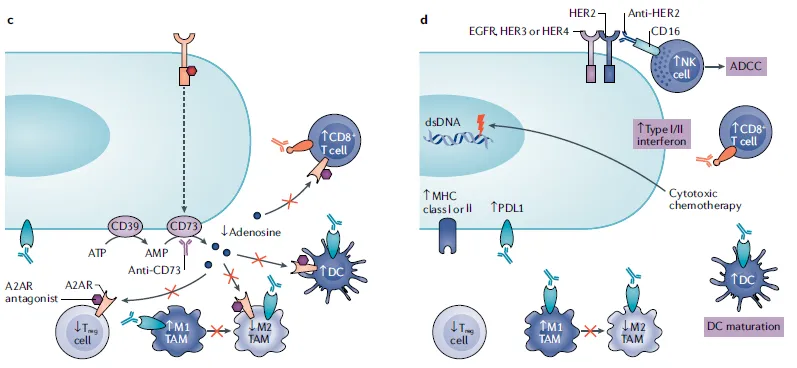
图4. 靶向ERBB信号通路的治疗与免疫治疗的组合疗法
ERBB家族成员的异常信号通过两个方面促进肿瘤的发展:增强细胞生长和/或存活;通过直接调节免疫系统建立免疫抑制的肿瘤微环境,使肿瘤逃避抗肿瘤免疫反应。靶向异常ERBB家族信号可能通过多种机制提高对ICIs的敏感性,包括上调肿瘤抗原呈递、干扰和灭活免疫抑制细胞(如Treg细胞和MDSCs)以及下调免疫抑制分子。分子靶向治疗与肿瘤免疫治疗的联合疗法可以提高抗肿瘤疗效,未来可能借由免疫基因组精确医学开发出最佳的肿瘤治疗方法。
ERBB受体靶向疗法与免疫疗法有复杂的cross-talk机制,因此在联合疗法的临床开发策略上更为复杂。迈杰转化医学有成熟的ERBB通路与免疫信号通路生物标志物研究方案,帮助相关组合疗法的新药研发临床试验,欢迎垂询MARKETING@MEDxTMC.com。
Antitumour immunity regulated by aberrant ERBB family signaling. Nat Rev Cancer. 2021 Jan 18.