
尿路上皮癌是最常见的泌 尿系统肿瘤之一,发生于肾盂、输尿管、膀胱和尿道。根据欧美人群数据,膀 胱癌 的发生率约占 90% , 上尿路上皮癌约占 10% 左右 [1] 。世界卫生组织( WHO )下属的国际癌 症研 究机构( IARC )公 布的数据显示, 2020 年全球新发癌症病例 1929 万,其中膀胱癌 57.3 万( 3.0% )排名十二; 2020 年全球死亡病例 996 万,其中膀胱癌 21.3 万( 2.1% )排名十四。其中,东亚男性膀胱癌发病率( 7.3/10 万)和女性膀胱癌发病率( 1.8 /10 万) [2] , 2022 年中国人群新诊断尿路上皮癌为 9.5 万人。 膀胱癌已是严重威胁国民健康的恶性肿瘤之一,规范化诊断及治疗对提高我国膀胱癌的诊疗水平具有重要意义。
尿路上皮癌中以膀胱癌占比最高(约 90% ),按是否侵犯肌层可以分为非肌层浸润性膀胱癌( non-muscle-invasive bladder cance r, N MIBC )和肌层 浸润性膀胱癌( muscle-invasive bladder cancer, MIBC ),另外还 有 占比约 1 0% 的上尿路 上皮癌( upper tract urothelial carcinoma, UTUC )。 NMIBC 包括 Tis 、 Ta 和 T1 分期的患者,而 MIBC 主要包括 T2 分期及以上的患者。 由于尿路上皮癌患者早期往往没有明显的临床体征, 约 10-15% 的膀胱癌患者确诊时已发生转移 [3] 。
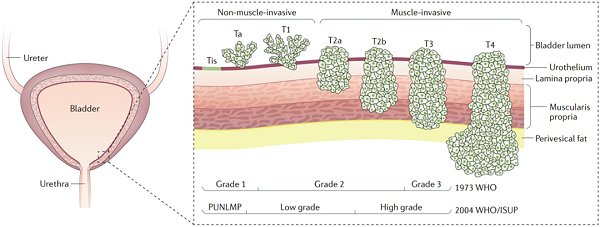
图1: 膀胱癌WHO分级
对于早期非肌层浸润性膀胱癌 ,通过经尿道膀胱肿瘤电切术(TURBT)切除,术后辅以膀胱灌注化疗药物和/或卡介苗治疗,5年生存(OS)率可达95% [4] ; 对于肌层浸润性膀胱癌 ,通过膀胱癌根治术治疗联合放化疗等手段,5年生存率约为69%。
以铂类药物为基础的联合化疗是转移性膀胱尿路上皮癌患者一线治疗最重要的基本方法,但5年生存率仅为15%[5]。此外,使用免疫单药的客观缓解率(ORR)也仅为20%左右,并且中位无进展生存期(PFS)不足3个月,近40%的患者仍不能从化疗及免疫单药治疗中获益。在二线及后线治疗方面,主要根据既往免疫、化疗失败进行分层选择,包括免疫单药、ADC、FGFR靶向治疗及后线化疗等,其中以PD-1、PD-L1单抗为主的免疫单药二线治疗将临床有效率从不到10%提高到20%左右。
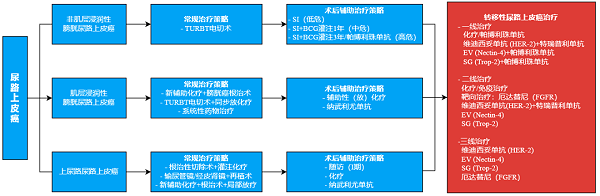
图2:尿路上皮癌诊疗方案 [6]
转移性尿路上皮癌患者一线治疗主要是以含铂化疗为标准治疗方式,化疗的有效率仅为 50% ,对于不能耐受铂类化疗的晚期尿路上皮癌患者, 使用 PD-1/L1 抑制剂单药治疗,也只能提升 10 % 左右的客观缓 解率,中位无进展生存期( PFS )为 2.2-2.7 个月。 并且 随着化疗敏感性下降,导致肿瘤复发和疾病进展,对于此类标准治疗后出现疾病进展的患者,后续治疗选择有限, 其中 以 PD-1 、 PD-L1 单抗为主的免疫单药二线治疗将临床有效率从不到 10% 提高到 20% 左右, 且中位无进展生存期( PFS )仅为 3.3 个月。 由此可见,分别约有 40% 和 80% 的转移性尿路上皮癌患者无法从化疗及免疫单药的一线或二线治疗中获益,面临尚无有效干预手段的窘境。
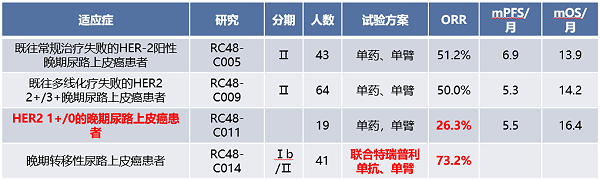
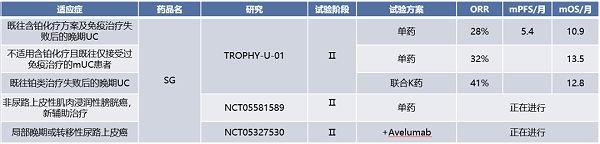
图3:尿路上皮癌维迪西妥单抗(HER-2)相关临床研究汇总
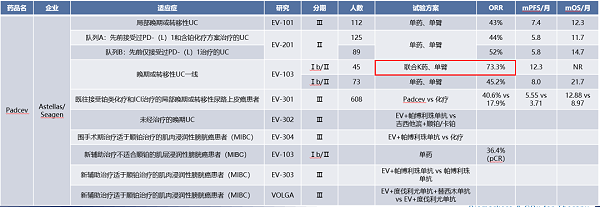
[1] Huang, K. L., Mashl, R.J., Wu, Y., Ritter, D.I., Wang, J., Oh, C., Paczkowska, M., Reynolds, S., Wyczalkowski, M.A., Oak, N., et al. (2018). Pathogenic germline variants in 10, 389 adult cancers. Cell 173, 355–370.e14;
[2] Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: a cancer journal for clinicians, 2021, 71(3): 209-249;
[3] 膀胱癌诊疗指南(2022年版)
[4] Siddiqui MR, Grant C, Sanford T, Agarwal PK(August 2017). Currentclinical trials in non-muscle invasive bladder cancer. Urologic Oncology.35(8):516-527;
[5] Bladder Cancer – Statistics. Cancer. Net. 25 June 2012;
[6] 《2023 CSCO 尿路上皮癌诊疗指南》
[7] Grivas P, et al. Primary analysis of TROPHY-U-01 cohort 3, a phase 2 study of sacituzumab govitecan (SG) in combination with pembrolizumab (Pembro) in patients (pts) with metastatic urothelial cancer (mUC) that progressed after platinum (PT)-based therapy.J Clin Oncol 41, 2023 (suppl 6; abstr 518)