
FLT3(FMS样酪氨酸激酶3,FMS-like tyrosine kinase 3)又叫CD135,在人体中由FLT3基因编码,属于Ⅲ型受体酪氨酸激酶(receptor tyrosine kinase, RTK)家族,该家族还包括PDGFR,FMS和KIT。FLT3由5个功能结构域组成,包括免疫球蛋白样胞外结构域、跨膜结构域、近膜结构域(JMD)、酪氨酸激酶结构域(TKD)和C-末端结构域[1]。
FLT3广泛表达于造血干细胞和祖细胞中 ,其配体(FL)通过骨髓基质细胞以膜结合或可溶性形式表达,造血系统中的很多细胞都可以表达FLT3配体(FL)。
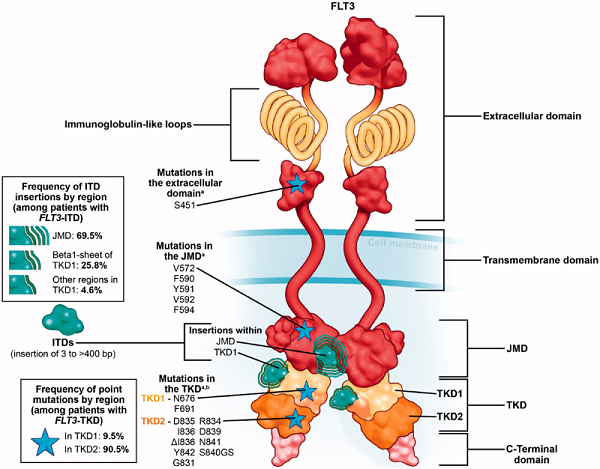
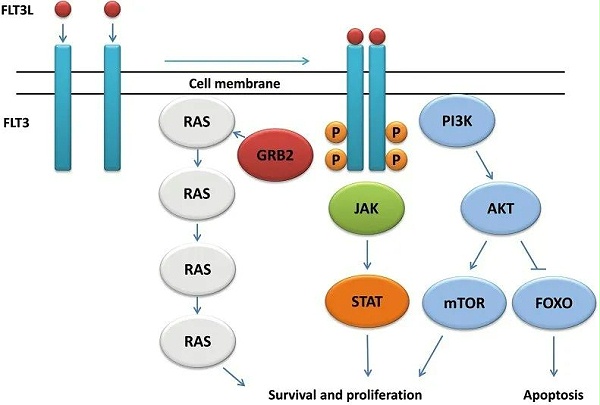
图2. FLT3信号通路示意图[2]
第二代药物作为选择性靶向FLT3抑制剂,与第一代抑制剂相比,疗效更好,特异性更强[3] 。根据智慧芽数据,全球共有132款靶向FLT3药物,其中终止或无进展的药物有44款,其余多数处于早期研发阶段,可见FLT3赛道的竞争逐步加剧。
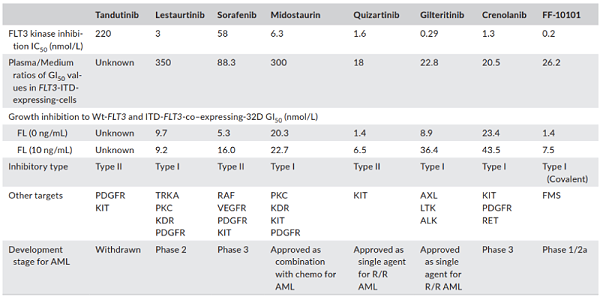
表1. 图片来源于参考文献 [4]
该方法的优点是可以直接反映病人体内的细胞用药后的状态,然而却受病人外周血单个核细胞数量的限制,一般患病后,患者外周血中PBMC数量减少,样本采集和处理在医院受限等因素,导致样本质量不合格,如得到PBMC数量过少,溶血等,导致得不到较理想的检测结果。
2)通过体外实验PIA方法,作为了一种替代方法,来检测病人给药前和给药后不同时间点的血药对表达突变型FLT3的细胞中Phospho-FLT3的抑制作用,间接评估药效 [5] 。
目前,血浆抑制活性(plasma inhibitory activity,PIA)测定取代血药浓度已被确立为评价FLT3抑制剂临床疗效的新指标,并已纳入临床试验的评价标准 [4] 。
在PIA分析中,将阳性细胞系与来自给药患者的血浆一起培养,然后收集细胞,获得细胞裂解液,通过WB/ELISA/MSD或者其他方法分析评估阳性细胞系的磷酸化状态,一般比较给药前和给药后的磷酸化水平。实验流程如下图所示。
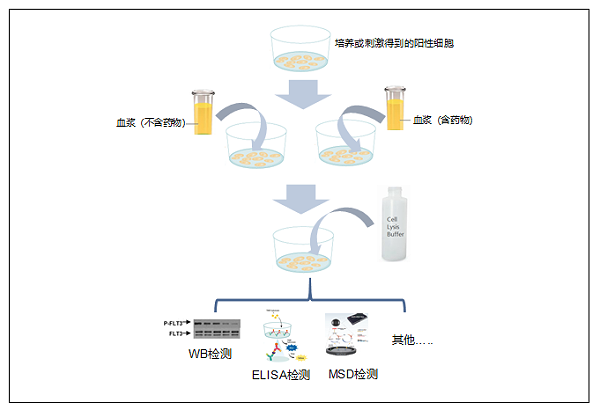
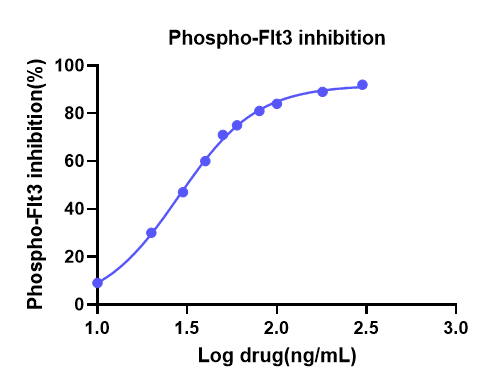
在PIA实验中,筛选合适的细胞系至关重要 , 细胞系的选择既要贴近临床适应症,又要对抑制剂有反应,一般需要对细胞系进行筛选。针对FLT3抑制剂关于AML研究的课题,我们选择了MV4-11细胞系。随机选取一例健康志愿者血浆样本,参考药代动力学参数,加入不同浓度的FLT3抑制剂,模拟药物进入人体血液,将生长至对数期的细胞饥饿处理后,将含药血浆和不含药血浆与细胞在细胞培养箱中共孵育,收集孵育后的细胞,然后 按照迈杰医学开发的方法进行Phospho-FLT3/Total-FLT3的检测来评价药物的效果。 Phospho-FLT3和Total-FLT3检测结果显示,血浆中药物能够明显抑制MV4-11细胞系中Phospho-FLT3的表达,最高能够达到90%左右,且随着抑制剂浓度的下降,Phospho-FLT3抑制率%也呈现下降趋势。
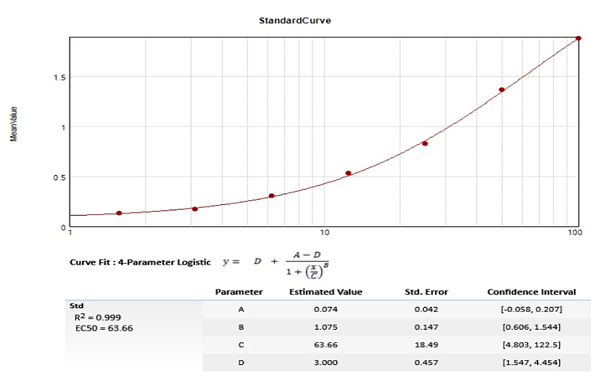
(1) 取培养的对数扩增期MV4-11细胞,收集,然后进行细胞计数,裂解总蛋白浓度上样量和OD值的关系进行拟合曲线(标准曲线,如图3所示);
( 2)拟合曲线确认后,将最高浓度点的值定义一个相对值100,其他的点依次按稀释比例递减,制定了标准曲线,可以做到Phospho-FLT3的相对定量;
(3)同时使用试剂盒检测total-FLT3,对检测结果进行均一化处理,使得抑制率计算更加准确。
迈杰医学中心实验室目前已开发了多种采用PIA实验检测磷酸化蛋白的方法,如FGFR1,P70S6K,4EBP1。 PIA方法:首先可以通过采集少量全血分离血浆即可满足检测的需求,这对儿童患者尤其重要,同时避免了医院分离PBMC的繁琐操作、全血需求量大以及医院处理条件的限制导致的PBMC样本质量不合格无法检测等问题;其次血浆样本的稳定性一般比PBMC更好。
此外,迈杰医学中心实验室能够提供药物临床试验过程中生物标志物检测方法的开发和验证, 包含PD细胞因子、可溶性蛋白、磷酸化/乙酰化蛋白、PK,ADA, Nab等,已完成上百项的方法开发和确认,能够提供更优质的服务。
[ 1 ] Patnaik MM. The importance of FLT3 mutational analysis in acute myeloid leukemia. Leuk Lymphoma . 2 018;59(10):2273-2286. doi:10.1080/10 428194.2017.1399312
[2] Chen Y, Pan Y, Guo Y, et al. Tyrosine kinase inhibitors
targeting FLT3 in the treatment of acute myeloid leukemia. Stem Cell
Investig. 2017;4:48. Published 2017 Jun 2. doi:10.21037/sci.2017.05.04
[3] Short NJ, Kantarjian H,
Ravandi F, Daver N. Emerging treatment paradigms with FLT3 inhibitors in acute
myeloid leukemia. Ther Adv Hematol. 2019 Feb 15;10:2040620719827310. doi:
10.1177/2040620719827310. PMID: 30800259; PMCID: PMC6378516.
[4] Kiyoi H, Kawashima N, Ishikawa Y. FLT3 mutations in acute
myeloid leukemia: Therapeutic paradigm beyond inhibitor development. Cancer
Sci. 2020;111(2):312-322. doi:10.1111/cas.14274
[5] Levis M, Brown P, Smith BD, et al. Plasma inhibitory activity
(PIA): a pharmacodynamic assay reveals insights into the basis for cytotoxic
response to FLT3 inhibitors. Blood. 2006;108(10):3477-3483.
doi:10.1182/blood-2006-04-015743
[6] Jennifer E Podesta, Melanie J Griffin, Richard Sugar, Matthew S Squires, Alan Boddy, Spiros Linardopoulos, Andrew DJ Pearson, Andrew S Moore; Adaptation and Validation of the Plasma Inhibitory Activity (PIA) Assay to Detect Inhibition of Aurora, ABL and FLT3 Kinases by AT9283 In Children and Adolescents with Leukaemia. Blood 2010; 116 (21): 1818. doi: https://doi.org/10.1182/blood.V116.21.1818.1818