
2020年5月6日,诺华(Norvatis)宣布其MET抑制剂Tabrecta (Capmatinib)获批上市,治疗携带MET基因14号外显子跳读的晚期非小细胞肺癌(NSCLC)患者,这是FDA批准的首个,全球第二个获批用于治疗携带MET基因突变的晚期NSCLS患者的口服MET抑制剂。

图1 诺华的MET抑制剂Tabrecta 获批
除了诺华的Tabrecta,德国默克(Merck KGaA)的Tepotinib(EMD1214063)也已获得日本厚生劳动省药事和食品卫生委员会批准上市,成为全球首款获批上市的c-MET抑制剂。Tepotinib是一种高选择性口服c-MET抑制剂,早在去年9月,即获得FDA授予的突破性疗法认定(BTD),用于治疗在铂类化疗后进展的具有MET基因外显子14跳跃突变的转移性NSCLC患者。除MET ex14外,Tepotinib可强效、高选择性抑制MET改变引起的致癌信号,包括MET扩增或MET蛋白过表达,具有改善携带这些特定MET变异的侵袭性肿瘤患者治疗预后的潜力。目前在中国,Tabrecta (Capmatinib)有2项临床试验进行,Tepotinib有4项临床试验正在进行。
MET基因变异和肿瘤发生
MET基因位于人类7号染色体长臂(7q21-31),长度约125 kb,含有21个外显子。C-MET,又称为酪氨酸激酶MET, c-MET是一种细胞表面的跨膜受体蛋白,和其配体HGF(肝细胞生长因子)结合后发生二聚酪氨酸磷酸化,继而激活众多下游信号通路如PI3K-Akt、Ras-MAPK、STAT和Wnt/β-catenin等,发挥促细胞增殖、细胞生长、细胞迁移及血管生成等效应(图1)。MET通路异常与多种癌症有关, c-MET也成为癌症治疗的热门靶点,诸多c-MET/HGF抑制剂药物处于临床研究phase II/III阶段。
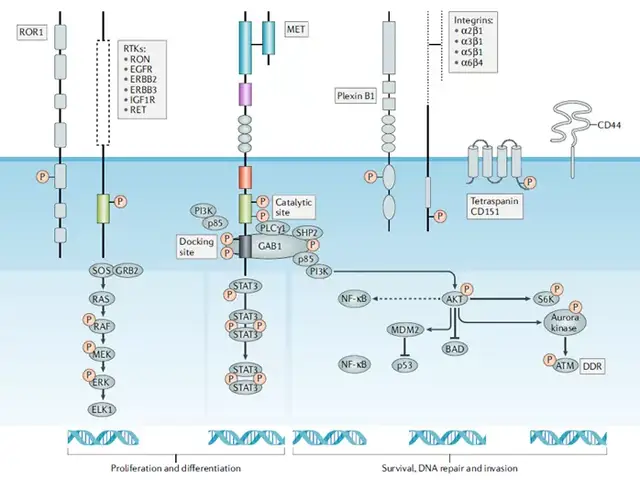
图2 通过c-Met激活的主要信号通路
c-MET抑制剂的生物标志物和伴随诊断
c-MET基因变异类型多样化,c-MET蛋白表达水平异常、基因扩增和基因突变都与癌症发生发展息息相关,使用c-MET生物标志物来进行患者筛选分层,大大提高了MET靶向药物临床研究的成功率。
针对c-MET基因突变、蛋白高表达和基因扩增的变异形式,相应的qRT-PCR (MET ex14跳读和MET扩增等异常检测),IHC (MET蛋白过表达)和原位免疫荧光杂交(FISH,检测MET扩增)都是临床研究中常用的手段,此外高通量测序方法(NGS)也越来越多的被应用于MET基因异常的检测。目前,任何单一的方法都无法保证全面检测出所有c-MET变异,多种方法结合更加有利于综合判断并精准筛选适宜的患者。
诺华Capmatinib(INC280)的GEOCMETRY Mono-1研究设计中,生物标志物策略在EGFR和ALK野生型NSCLC患者中,不考虑MET扩增状态/基因拷贝数,使用RT-PCR方法检测c-MET ex14(图2)。Merck在Tepotinib临床试验VISION研究中通过液体活检或肿瘤/组织活检鉴定以RNA为基础的MET ex14突变,检测入组NSCLC患者中的METex14突变。诺华与Roche的Foundation Medicine合作,Capmatinib的伴随诊断开发策略或许采用NGS手段,包括用于肿瘤组织和液体活检,该伴随诊断方法将被纳入FoundationOne®CDx(F1CDx)伴随诊断产品以及即将推出的Foundation Medicine公司的液体活检平台。
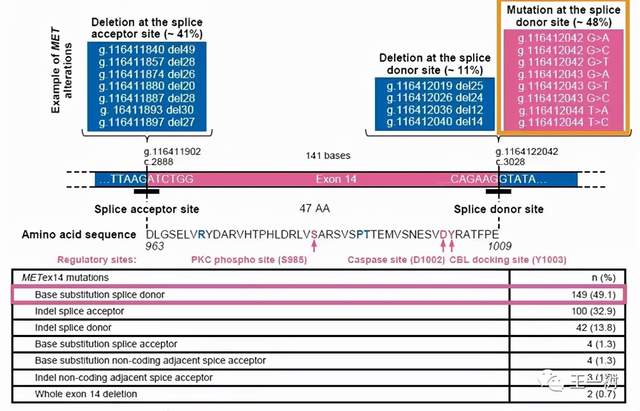
图3:GEOCMETRY Mono-1研究MET 14外显子跳跃突变类型 图3:GEOCMETRY Mono-1研究MET 14外显子跳跃突变类型
迈杰转化医学c-MET生物标志物研究策略及经验分享
基于c-Met过表达和MET ex14跳读的临床意义,迈杰转化医学研究(苏州)有限公司基于综合的转化医学技术平台进行了c-Met相关生物标志物的深入研究。IHC,FISH,ARMS Q-PCR,NGS靶向测序等多个平台都已经过充分技术验证,在DNA,RNA以及蛋白层面充分评价c-Met相关生物标志物的状态,为临床研究及诊疗提供中心实验室技术检测服务和伴随诊断产品开发服务。其中,基于核酸平台的cMET 14外显子跳读检测试剂盒(qRT-PCR)目前在准备申报临床研究,已与国内外多家创新药企洽谈或启动了伴随诊断产品的合作开发。
1. 基于病理平台的c-Met过表达检测试剂盒(IHC)
基于病理平台开发的c-Met过表达检测IHC试剂盒,经方法学验证制定出如下评分标准:
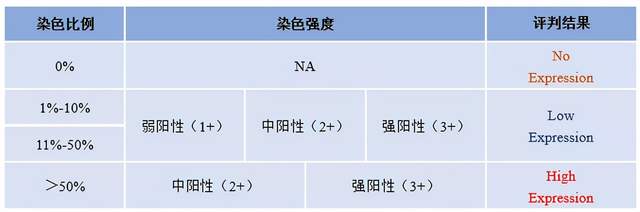
表1 c-Met过表达检测IHC试剂盒评分标准
基于以上评判标准,对如下图的IHC染色结果进行分析。图4(A)显示染色比例为11%-50%,染色强度为中阳性(2+),因此该患者肿瘤组织c-Met检测结果为低表达;图4(B)显示染色比例>50%,染色强度为中阳性(2+),因此该患者肿瘤组织c-Met检测结果为高表达。其中图4(C)和图4(D)均无染色,染色比例为0%,即c-Met不表达。
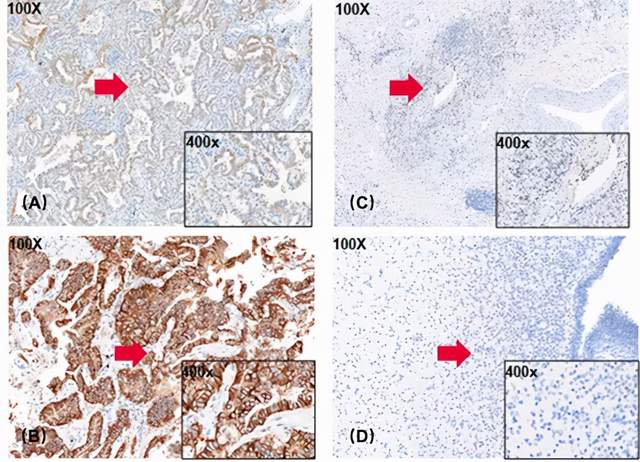
图4 肿瘤患者组织IHC染色结果
2. 荧光原位杂交方法(FISH)
迈杰转化医学建立了c-Met基因扩增的FISH检测方法,其评判标准如下表所示:
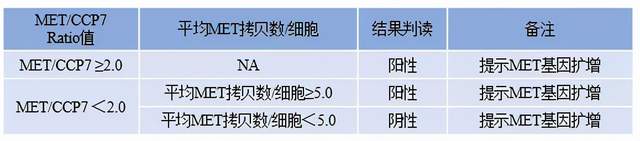
表2 c-Met基因扩增的FISH检测评判标准
图5(A)为非小细胞肺癌患者组织样本的FISH检测结果,分析显示MET/CCP7=3.90﹥2.0,平均MET拷贝数/细胞=23.40﹥5.0,提示MET基因扩增为阳性;图5(B)为肾癌患者组织样本的FISH检测结果,分析显示MET/CCP7=1.04﹤2.0,平均MET拷贝数/细胞=2.65﹤5.0,提示MET基因扩增为阴性。
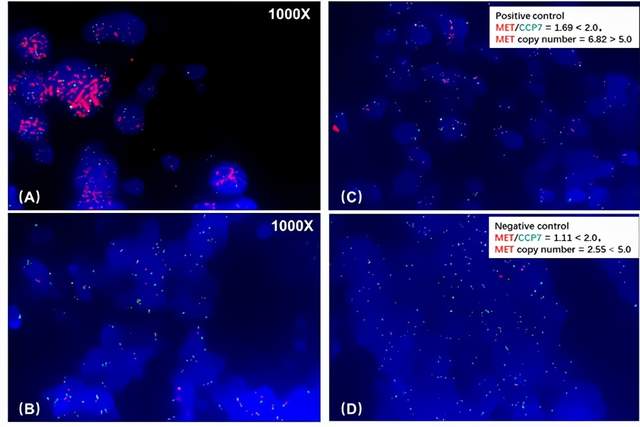
图5 非小细胞肺癌患者组织样本的FISH检测结果
3. c-Met 14外显子跳读检测试剂盒(q-PCR)
基于q-PCR平台,我们自主研发出一种可从RNA水平特异性检测c-MET外显子14跳读突变的检测试剂盒,操作简便,快速精准,可以更直观的满足临床快速检测的实际需求,用于指导Crizotinib等c-MET靶向药物的使用。
如图7所示:采用双荧光标记,FAM标记靶基因c-MET,VIC标记内参照基因B2M (beta-2微球蛋白)。当B2M的ct值大于10,小于等于36时,检测有效;当B2M的ct值小于10 (模板浓度过高)或大于36(模板浓度过低)时,检测无效。c-MET的ct值≤41,检测为阳性;如果>41,则检测为阴性。
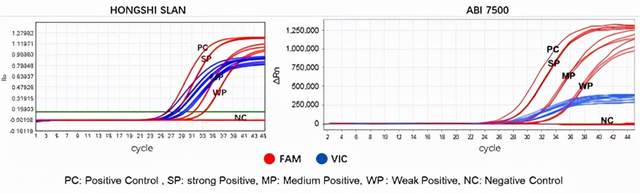
图6 c-Met 14外显子跳读检测试剂盒检测结果展示
4. Med1CDx-601 基因panel (NGS平台)
迈杰转化医学的Med1CDx综合panel包含了几乎所有已知原癌基因、遗传性驱动基因、细胞周期基因和免疫/炎症相关基因等601个基因,可用于对TMB、MMR、MSI、免疫检查点分子、肿瘤新生抗原和HLA分型等全方位的分析、评估,其中也涵盖了c-Met 外显子区域,即Med1CDx可对MET基因变异(可反推 Exon14 跳读)和基因异常扩增进行精准检测,同时可对c-MET信号通路相关的其他信号通路做全景描绘,为精准诊断和临床用药提供更准确的指导。
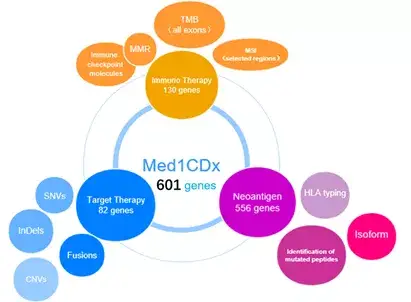
图7 Med1CDx-601 基因panel
关于更多c-MET生物标志物研究方案,敬请垂询!
Reference
1. Eder J P , Vande Woude G F ,Boerner S A , et al. Novel Therapeutic Inhibitors of the c-Met SignalingPathway in Cancer[J]. Clinical Cancer Research, 2009, 15(7):2207-2214.
2. Wang Q , Yang S , Wang K , etal. MET inhibitors for targeted therapy of EGFR TKI-resistant lung cancer[J].Journal of Hematology & Oncology, 2019, 12(1).
3. 沃利替尼治疗MET外显子14跳变非小细胞肺癌患者的II期研究:初步疗效和安全性结果。摘要5707,2019 CSCO.
4. Lee GD, LeeSE, Oh DY, et al. MET Exon 14 Skipping Mutations in Lung Adenocarcinoma:Clinicopathologic Implications and Prognostic Values.. J Thorac Oncol. 2017Aug;12(8):1233-1246.
5. Pasquini G,Giaccone G. C-MET inhibitors for advanced non-small cell lung cancer. ExpertOpin Investig Drugs. 2018 Apr; 27(4):363-375.
6. Comoglio P M, Giordano S , Trusolino L . Drug development of MET inhibitors: targetingoncogene addiction and expedience[J]. Nature Reviews Drug Discovery, 2008,7(6):504-516.
7. Bok-Soon Lee,Haeng-Jun Kim, Jae-WoongHwang, et al. The dual inhibition of Met and EGFR byME22S, a novel Met/EGFR bispecificmonoclonal antibody, suppresses theproliferation and invasion of laryngealcancer. Ann Surg Oncol. 2016,23:2046-53.
8. SiYang Liu,LanYing Gou, AnNa Li, et al. The Unique Characteristics of MET Exon 14 Mutationin Chinese Patients with NSCLC.[J]. journal of thoracic oncology, 2016,11(9):1503-1510.
9. ThanyananReungwetwattana et al. The race to target MET exon 14 skipping alterations innon-small cell lung cancer: The Why, the How, the Who, the Unknown, and theInevitable . Lung Cancer, Volume 103, January 2017, Pages 27-37.
10. Wang Q, YangS, Wang K, et al. MET inhibitors for targeted therapy of EGFR TKI-resistantlung cancer. J Hematol Oncol. 2019 Jun 21;12(1):63.
11. Guo Y, CaoR, Zhang X, et al. Recent Progress in Rare Oncogenic Drivers and TargetedTherapy For Non-Small Cell Lung Cancer. Onco Targets Ther. 2019 Nov28;12:10343-10360.
12. Sequist LV,Han JY, Ahn MJ, et al. Osimertinib plus savolitinib in patients with EGFRmutation-positive, MET-amplified, non-small-cell lung cancer after progressionon EGFR tyrosine kinase inhibitors: interim results from a multicentre,open-label, phase 1b study. Lancet Oncol. 2020 Feb 3.pii: S1470-2045(19)30785-5.
13. Moores SL,Chiu ML, Bushey BS, et al. A Novel Bispecific Antibody Targeting EGFR and cMetIs Effective against EGFR Inhibitor-Resistant Lung Tumors. Cancer Res. 2016; 76:3942–53.
14. Sun Z J , WuY , Hou W H , et al. A novel bispecific c-MET/PD-1 antibody with therapeuticpotential in solid cancer[J]. Oncotarget, 2017, 8(17).