
骨髓增殖性肿瘤(Myeloproliferative Neoplasms,MPN)是一大类起源于造血干细胞、以髓系造血细胞一系或多系过度增殖为特征的恶性疾病,主要包括真性红细胞增多症(Polycythemia Vera, PV)、原发性血小板增多症(Essential Thrombocythemia,ET)、原发骨髓纤维化(Primary Myelofibrosis,PMF)、慢性粒细胞性白血病(Chronic Myelogenous Leukemia,CML)。研究表明,MPN通常伴有JAK2基因1849位(G/T)突变,导致该蛋白第617位的缬氨酸(V)改变为苯丙氨酸(F),从而引起一系列病变。在PV患者中JAK2-V617F大约有90%-95%的突变率,而在ET和PMF中突变率约为50-60%。
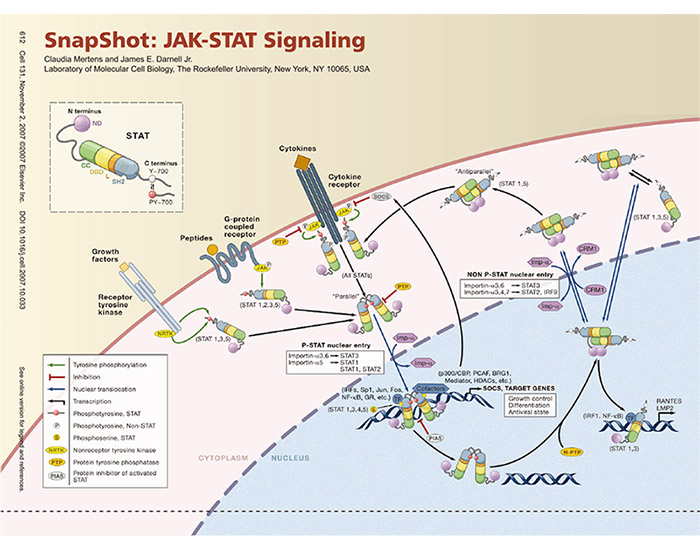
JAK-STAT信号通路
WHO(2008)明确将JAK2-V617F的突变作为MPN主要诊断指标之一;WHO(2016)分类指南中,JAK2检测成为诊断MPN的主要标准;NCCN(2019)指南明确将JAK2-V617F等分子诊断列为检测内容。

最低检测限低至10ng/25μl, 0.3%突变率。

检测时间快,提取到结果只需3小时。

同时适用ABI 7500及宏石Slan平台。
| 序号 | 组分名称 | 组成成分 | 数量 |
| 1 |
JAK2 反应液 |
PCR缓冲液、特异性弓|物和探针、内参引物和探针 | 1支 |
| 2 | 反应酶 | 热启动Taq DNA聚合酶、UDG酶 | 1支 |
| 3 |
JAK2 阳性质控品 |
JAK2-V617F质粒、内参质粒 | 1支 |
| 4 | 空白对照品 | 鲑鱼精DNA | 1支 |
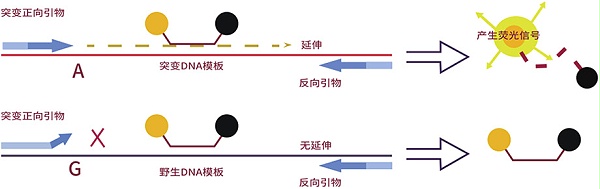
MPN的辅助诊断和预后判断
 创新诊断产品研发
创新诊断产品研发
● 迈杰转化医学的管理和技术研发团队,博士比例高于20%。
● 全组学平台专注药物伴随诊断研发及商业化,涵盖靶向治疗、免疫治疗和细胞治疗等产品。
● 已有多个诊断产品上市,多款产品进入临床试验阶段,同时还有多个肿瘤新药伴随诊断 产品进入研发管线。
 高标准质量体系
高标准质量体系
● 建立了覆盖全平台的产品研发实验室和质检实验室。
● 按照GMP和ISO 13485的要求建立覆盖全平台产品生产的生产车间。
● 研发实验室和生产车间已获的欧盟ISO 13485 认证证书,满足IVD/CDx产品设计 生产要求,通过NMPA 质量体系考核。