MRD即微小残留病灶(Minimal Residual Disease),是指在患者接受治疗期间或之后,其体内仍有少量肿瘤细胞或者微小病灶的临床状态,也叫分子残留病变(Molecular Residual Disease), MRD 阳性意味着癌症治疗后血液中可检测到来自肿瘤的DNA(发现癌细胞,癌症治疗后残留的癌细胞会变得活跃并开始繁殖,导致疾病复发) ;阴性结果表示癌症治疗后未检测到残留(剩余)病灶。许多研究都表明,如果MRD无法自行代谢或者被机体的免疫机制清除,反而持续增长,患者有极大概率在根治术后肿瘤复发。目前,全球有多项观察性临床研究的数据验证了在多个泛实体瘤癌种中,接受了根治性治疗的MRD阳性患者,复发概率远高于MRD阴性患者,如果执行辅助化疗后,患者的MRD状态仍为阳性,则属于复发的高风险人群。
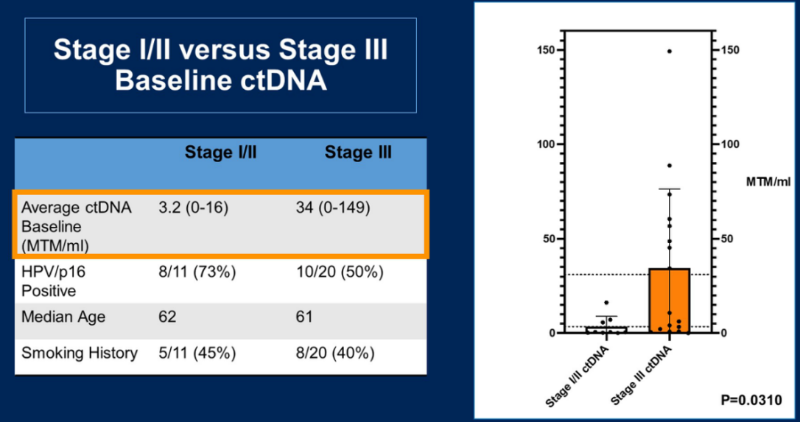
图1. I/ll/III期患者ctDNA基线水平
在治疗中期进行的检测显示,共有57%的患者在21天内实现ctDNA转阴,对不同期别患者进行的分层分析显示,73%的I/II期患者在30天内实现ctDNA转阴,50%的III期患者在31天内实现ctDNA转阴。
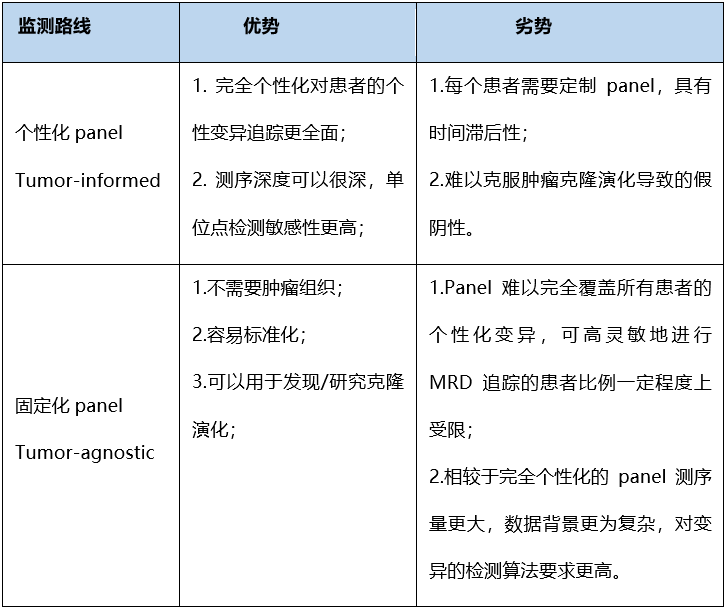
肿瘤组织未知分析(Tumor-agnostic assays)不需要获取肿瘤组织,直接对血液进行MRD检测。肿瘤组织未知(Tumor-agnostic )策略主流是用一个普适性、一般有三四百个基因甚至更多基因的大panel进行检测,相当于固定化panel的检测。采用固定的panel,无须预先获取患者肿瘤组织进行测序,可以大幅简化流程、降低成本及缩短患者MRD状态评估周期。然而,tumor-agnostic assay对固定化panel的设计要求更高。在2021年ASCO会议的一项临床研究显示,分析接受根治手术的400例结直肠癌患者的ctDNA MRD状态研究可知,分布在4425个基因的6400个突变位点中,每位患者独有基因占75%,只有2位患者出现共有基因占17%,3位及以上患者共有基因≤5%。因此,如何设计固定化panel,能够对不同患者都有一定数目的突变覆盖,并且采用经广泛验证的算法分析从而用于MRD检测,是tumor-agnostic assay需要重点克服的难点。两种策略的优劣势如下表1所示:
表1. 两种检测路线优劣势对比
目前迈杰医学自主开发了基于tumor-informed策略的泛实体瘤MRD检测产品,本产品的肿瘤组织检测体系WES-Plus为19800余个基因全部外显子和部分内含子区域,并对与肿瘤发生发展密切相关的601个基因进行了加密。鉴定出患者的变异图谱后,针对每个患者挑选20个突变位点进行个性化panel定制,定制panel经生产及质控合格后,对患者血浆cfDMA样本进行 超高深度测序(≥100000×),进而用于血浆中痕量的ctDNA MRD监测,检测流程如下图所示。
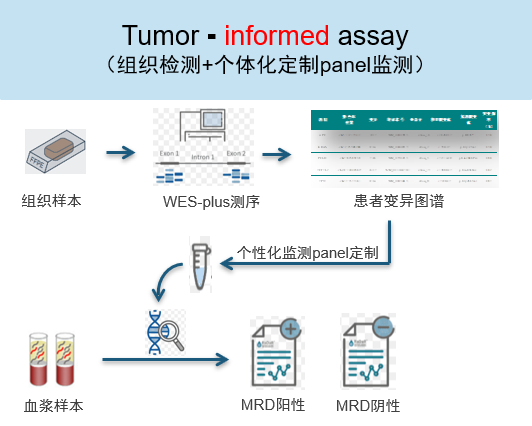
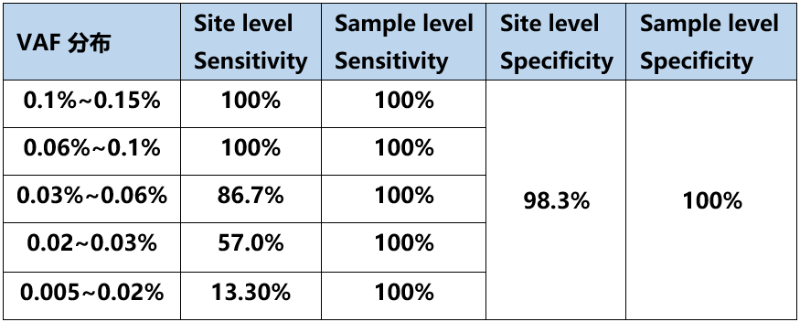
图3. 标准品位点的检出情况(*标记为检出)
在位点层面(site level)对于不同突变频率水平的位点,随着突变频率的降低,检出灵敏度也相应降低,总体位点特异性为98.3%。以≥95%检出作为最低检测限LoD判断标准,汇总分析所有位点检出情况可得,迈杰医学MRD监测体系单点水平LoD可达0.03%。
迈杰医学自行研发的泛实体瘤MRD产品已全面上线,产品检测panel覆盖面广泛,支持多种实体瘤MRD检测,目前在肺癌、结直肠癌、肝癌及食管鳞癌中已有丰富项目经验。
参考文献
[1] Reinert T , Henriksen T V , Christensen E , et al. Analysis of Plasma Cell-Free DNA by Ultradeep Sequencing in Patients With Stages I to III Colorectal Cancer[J]. JAMA Oncology, 2019, 5(8).
[2] Tarazona N , Gimeno-Valiente F , Gambardella V , et al. Targeted next-generation sequencing of circulating-tumor DNA for tracking minimal residual disease in localized colon cancer[J]. Annals of Oncology, 2019, 30(11):1804-1812.
[3] Tie J , Cohen J D , Wang Y . Circulating Tumor DNA Analyses as Markers of Recurrence Risk and Benefit of Adjuvant Therapy for Stage III Colon Cancer (vol 66, pg 584, 2019)[J]. JAMA oncology. 2019(12):5.
[4] Garcia-Murillas I , Chopra N , I Comino-Méndez, et al. Assessment of Molecular Relapse Detection in Early-Stage Breast Cancer[J]. JAMA Oncology, 2019, 5(10):1473-.
[5] Sausen M , Phallen J , Adleff V , et al. Clinical implications of genomic alterations in the tumour and circulation of pancreatic cancer patients[J]. Nature Communications, 2015:7686.
[6] Chaudhuri AA, Chabon JJ, Lovejoy AF, Newman AM, Stehr H, Azad TD, Khodadoust MS, Esfahani MS, Liu CL, Zhou L, Scherer F, Kurtz DM, Say C, Carter JN, Merriott DJ, Dudley JC, Binkley MS, Modlin L, Padda SK, Gensheimer MF, West RB, Shrager JB, Neal JW, Wakelee HA, Loo BW Jr, Alizadeh AA, Diehn M. Early Detection of Molecular Residual Disease in Localized Lung Cancer by Circulating Tumor DNA Profiling. Cancer Discov. 2017 Dec;7(12):1394-1403. doi: 10.1158/2159-8290.CD-17-0716. Epub 2017 Sep 24. PMID: 28899864; PMCID: PMC5895851.
[7] Reinert T , Henriksen T V , Christensen E , et al. Analysis of Plasma Cell-Free DNA by Ultradeep Sequencing in Patients With Stages I to III Colorectal Cancer[J]. JAMA Oncology, 2019, 5(8).
本文标签: 实体肿瘤试剂 检测试剂盒 血液肿瘤试剂 传染病医疗检测试剂
咨询热线
400-007-1121央视《匠心》栏目视角看迈杰转化医学