重新分析试验样品可能基于下列理由:
在由于给药前样品阳性结果或者由于药动学原因进行重新分析的情况下,应该提供重新分析样品的身份、初始值、重新分析的理由、重新分析获得值、最终接受值以及接受理由。
在仪器故障的情况 下,如果已经在方法验证时证明了重新进样的重现性和进样器内稳定性,则可以将已经处理的样品重新进样。但对于拒绝的分析批,则需要重新处理样品。
除了9012指南第1条中包括的各个条目,研究样品分析开始前,应该在方案、研究计划或SOP中预先规定重新分析研究样品的重复次数。
除了9012指南第2条中列举的各个重新分析理由外,研究样品重分析的理由还可以是:
除了9012指南第3条中要求提供的各项信息,还要求将这些信息汇总成表,并增加针对每种原因重新分析的样本总数的汇总表。
在9012指南第4条的基础上,M10指南还强调了仅仅因为校正标样或质控样品失败,而没有任何确定的分析原因,就重新进样一个完整的分析批或个别校正标样或质控样品是不可接受的。
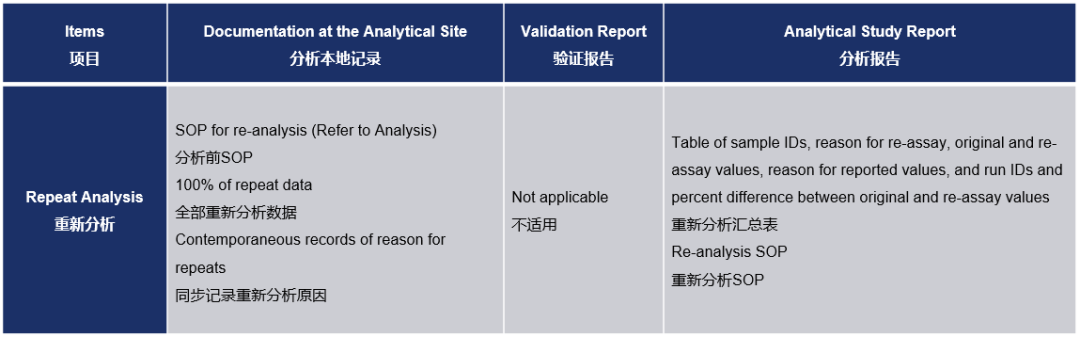
除了对9012指南条目的增补外,M10指南还对重新分析做了如下规定:

GBC最佳实践中提供了生物样品重新分析的流程 ,重新分析可按原因分为两大类:
第一类为“分析原因”或“可确定原因”的重新分析
原因:包括仪器功能异常,质控品不符合接受标准,检测结果超过定量限等,已在9012指南中予以概括,这种情况下应以第一次有效的重新分析值作为最终报告值。
第二类为“结果不一致”或“药代动力学”原因的重新分析
如果没有足够的样本量进行复孔检测,只能进行单次重新分析。则将初次分析值和重新分析值按前述公式进行一致性分析,如果一致性通过,汇报平均值,如果一致性不通过,则进行专家讨论后取值汇报,或汇报“NR”。同样需出具取值理由说明。
本文标签: 实体肿瘤试剂 检测试剂盒 血液肿瘤试剂 传染病医疗检测试剂
咨询热线
400-007-1121央视《匠心》栏目视角看迈杰转化医学